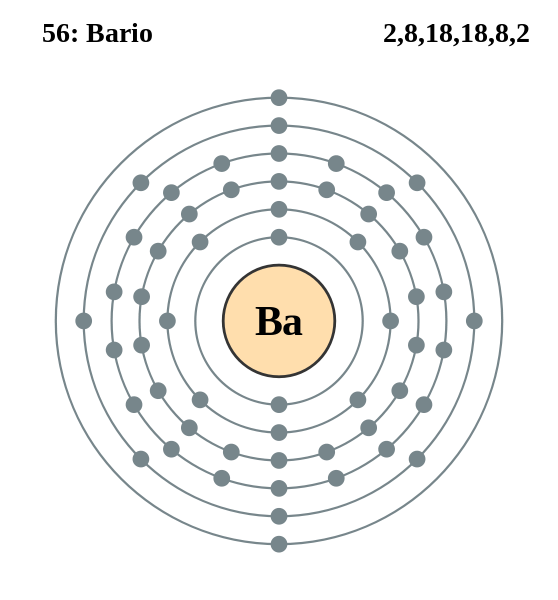
La existencia de este elemento Bario fue dada por Schelee en 1774. Schelee diferencio la barita (Oxido de Bario) con la cal (Oxido de Calcio), nombrando la primera como tierra pesada, debido a que los compuestos que el Bario formada tenían una densidad relativamente grande, lo cual determinaba mayor peso. Su nombre se deriva del griego "barys" que significa "pesado", en atención a la gran densidad de los muchos compuestos que formaba.
Posteriormente el elemento Bario fue descubierto por Sir Humphrey Davy en Inglaterra en el 1808, en donde el bario, en su forma natural fue aislado por este mismo mediante electrolisis de barita fundida con óxido de mercurio (II), obteniendo una amalgama de bario.
Sir Humphry Davy (Penzance, Cornualles, 17 de diciembre de 1778 - Ginebra, Suiza, 29 de mayo de 1829) fue un químico británico. Se le considera el fundador de la electroquímica, junto con Alessandro Volta y Michael Faraday.
Davy contribuyó a identificar experimentalmente por primera vez varios elementos químicos mediante la electrólisis, y estudió la energía involucrada en el proceso, desarrolló la electroquímica explorando el uso de la pila de Volta o batería. Entre 1806 y 1808 publica el resultado de sus investigaciones sobre la electrólisis, donde logra la separación del Magnesio, Bario, Estroncio, Calcio, Sodio, Potasio y Boro.
Posteriormente el elemento Bario fue descubierto por Sir Humphrey Davy en Inglaterra en el 1808, en donde el bario, en su forma natural fue aislado por este mismo mediante electrolisis de barita fundida con óxido de mercurio (II), obteniendo una amalgama de bario.
Sir Humphry Davy (Penzance, Cornualles, 17 de diciembre de 1778 - Ginebra, Suiza, 29 de mayo de 1829) fue un químico británico. Se le considera el fundador de la electroquímica, junto con Alessandro Volta y Michael Faraday.
Davy contribuyó a identificar experimentalmente por primera vez varios elementos químicos mediante la electrólisis, y estudió la energía involucrada en el proceso, desarrolló la electroquímica explorando el uso de la pila de Volta o batería. Entre 1806 y 1808 publica el resultado de sus investigaciones sobre la electrólisis, donde logra la separación del Magnesio, Bario, Estroncio, Calcio, Sodio, Potasio y Boro.